治験をご希望の方
標準業務手順書
企業治験
- 治験実施標準業務手順書(企業治験)
- 治験審査委員会 標準業務手順書(企業治験)
- 補遺:再生医療等製品治験
-
医師主導治験
- 治験実施標準業務手順書(医師主導治験)
- 治験審査委員会 標準業務手順書(医師主導治験)
-
治験手続きにおける電磁化標準業務手順書
- Agathaを利用した治験関連文書の電磁化に関する標準業務手順書電磁化チェックリスト
治験実施体制
1.治験管理室について
-
治験管理室は地下1階、薬剤部内に設置されています。ご訪問の際は、まず薬剤部までお越しください。
-
2人体制で実施(専任2名)
-
よくある質問に関しては以下のリンクをご覧ください。
2.CRC
契約SMO2社(CRC業務、事務局業務の支援)
3.治験薬管理
-
薬剤部内の独立した場所で管理しています。
-
複数の温度計で温度管理を実施しています。
-
冷蔵庫は無停電装置に接続してあり、停電時等も対応できます。
4.EDCについて
-
インターネット使用環境は整っています。日本語・英語ともに経験しております。
-
音声応答システム(IVRS)やWeb自動応答システム(IWRS)も日本語・英語ともに経験しております。
5.SDVについて
実施可能時間:9時~17時
実施場所 :治験管理室SDV専用スペース
予約方法 :Web(Pr.JOY)にてご希望の日時をご提示ください。
※Pr.JOY・・・外部業者用の入退館管理システム
-
電子カルテ利用者ID付与のため、事前に電子カルテ利用の登録申請書を提出してください。電子カルテ操作に関するトレーニングはありませんが必要な場合はお声かけください。
「電子カルテ利用の登録申請書」はこちら
6.治験実績について
| 診療科 | 対象疾患 |
|---|---|
| リウマチ科・膠原病内科 | 関節リウマチ |
| 循環器内科 | 急性冠症候群、ステント治療を要する冠動脈疾患心房細動、心不全、治療抵抗性高血圧 |
| 泌尿器科 | 抗悪性腫瘍剤投与に伴う悪心・嘔吐 前立腺癌、尿路結石、膀胱癌 |
| 神経内科 | 筋委縮性側索硬化症、パーキンソン病、脳梗塞 |
| 腫瘍内科 | 転移性乳癌、化学療法時の発熱性好中球減少症 がん性疼痛 |
| 乳腺外科 | 乳癌 |
| 内分泌代謝内科 | 糖尿病性神経障害性疼痛、成人成長ホルモン分泌不全症 活動性先端巨大症/下垂体性巨人症 |
| 皮膚科 | 尋常性乾癬、帯状疱疹後神経痛、アトピー性皮膚炎 |
| 耳鼻咽喉科 | 中耳炎 |
| 整形外科 | 変形性関節症 |
7.お問い合わせ先
治験の手続きの手順
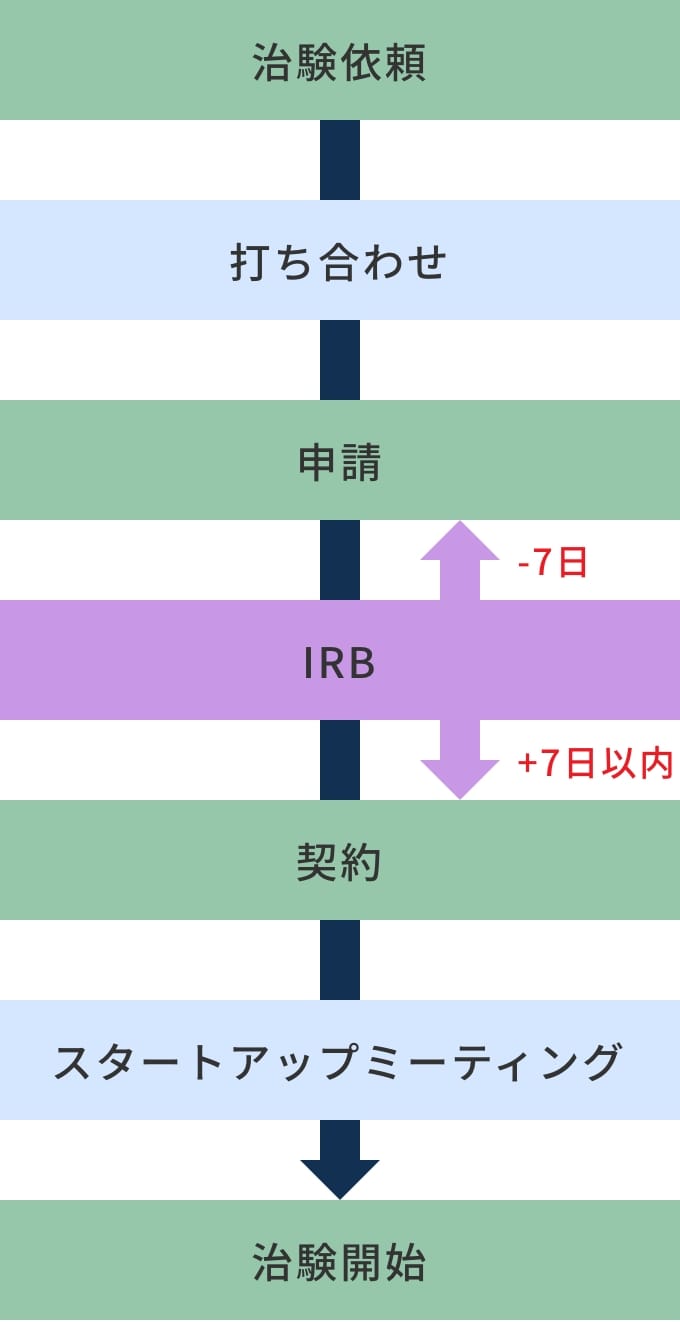
1.依頼
当院で治験の実施をお考えの場合、治験管理室へメールでご連絡ください。
打ち合わせの日程等を調整させていただきます。
横浜労災病院 治験管理室
Mail:tiken@yokohamah.johas.go.jp
2.打ち合わせ
-
事務局並びにCRC(SMO)へプロトコルの説明をお願いします。
-
選定調査が終了し、正式に依頼が決定した後に運用等についての打合せを行います。プロトコルの説明のみは打合せに含みません。再度の訪問をお願いします。
3.申請
契約SMO2社(CRC業務、事務局業務の支援)
4.IRB
治験審査委員会で、治験実施の可否を審査します。
5.承認
治験管理室より、病院長決裁後の通知書・契約書等をお渡しします(SMOによる事務局業務支援がある場合にはSMOよりお渡しします)。
6.契約
7.搬入
治験薬の搬入・検査キット等の納品は、治験管理室と日程を協議・決定します。
8.スタートアップミーティング
スタートアップミーティングについて治験管理室と協議します。
9.治験開始
10.その他
プロトコルの説明、打合せ、スタートアップミーティングの際にご訪問をお願いします。それ以外は、メール・郵送等での相談でかまいません。ただし、必要に応じて他部署(検査部、放射線部等)への説明をお願いします。
治験の手続きについて
依頼内容変更等の手順
1. 変更依頼
-
責任医師に、変更内容等を説明し、内諾を得てください。
-
事務局並びにCRCに、変更内容等を説明してください。
2.変更申請
治験管理室に変更申請書類等を治験審査委員会の2週間前までに郵送又は提出してください。
変更申請書類等
3.審査・承認
-
治験審査委員会で、変更等の可否を審査します。
-
治験管理室より、病院長決裁後の通知書・契約書等をお渡しします(SMOによる事務局業務支援がある場合にはSMOよりお渡しします)。
治験の申請に必要な書類
IRB審議2週間前
| 診療科 | 提出部数 |
|---|---|
| 治験と治験薬の概要 | 15部 |
| 同意説明文書 | 15部 |
IRB審議2週間前
| 診療科 | 提出部数 (治験管理室へ提出) |
IRB審議用 |
|---|---|---|
| 治験と治験薬の概要(※) | 正1 | 写15 |
| 書式4 治験審査依頼書(※) | 正1 | |
| 書式5 治験審査結果通知書(※) | 正1 | |
| 書式3 治験依頼書(※) | 正1 | 写15① |
| 書式1 履歴書(※) | 正2 | 写15② |
| 書式2 治験分担医師・治験協力者リスト(※) | 正1 | 写15③ |
| 様式1 受託研究費算定内訳書 | 正1 | 写15④ |
| 別紙1 受託研究経費ポイント算出表(製造販売後臨床試験は別紙2) | 正1 | 写15⑤ |
| 別紙5 院内CRC業務経費ポイント算出表 | 正1 | 写15⑥ |
| 別紙2 治験薬管理経費ポイント算出表(製造販売後臨床試験は別紙4) | 正1 | 写15⑦ |
| 受託研究費算出内訳書(観察期脱落・電磁化システム利用料) | 正2 | 写15⑧ |
| 様式9-1 治験契約書(二者契約の場合) 様式9-2 治験契約書(三者契約の場合) |
正2 正3 |
|
| 様式9-3 覚書(二者契約の場合)(※) 様式9-4 覚書(三者契約の場合)(※) (第3条のCRO業務内容を変更する場合など) |
正2 正3 |
|
| 治験に係る必須文書保管ファイル (新規申請用・病院保管用・責任医師保管用・安全性情報保管用) |
4冊 | |
| 審議用別冊ファイル(fileしindexを付ける) 1) 治験実施計画書 2) 治験薬概要書 3) 症例報告書の見本 4) 説明文書・同意文書 5) 被験者への支払いに関する資料 6) 被験者の健康被害に対する補償に関する資料 7) 被験者の募集の手順に関する資料 |
正15 |
(※)の付いている書式は、各書式一覧からダウンロードすることができます。
注意事項
-
書類の原本は治験管理室でもお渡しできます。
-
入力されている部分は、変更しないでください。
-
IRB開催予定日の1週間前17時までに、指定書類をすべて取りそろえ治験管理室に提出してください。
-
新規治験を申請する場合は、提出前に治験管理室でチェックを受けてください。
-
IRB開催日は治験依頼者に通知することなく変更されることがあります。
-
IRBの結果は院長決裁されるまで公表していません。
-
治験管理室との連絡は、e-mail で行なってください。
-
治験管理室への電話は、緊急を要する場合のみお願いします。
-
治験中の変更事項(プロトコールの変更、治験期間の延長、有害事象の報告など)は、治験管理室に必要書類を提出してください。
-
IRB審議用資料は①〜⑧の順に左上で留めて15部提出してください。
-
契約書・覚書は依頼者の署名・捺印の上、提出してください。
各書式一覧
統一書式番号:資料名
- 書式1:履歴書(Word)
- 書式2:治験分担医師・治験協力者 リスト(Word)
- 書式3:治験依頼書(Word)
- 書式4:治験審査依頼書 (Word)
- 書式5:治験審査結果通知書 (Word)
- 書式6:治験実施計画書等修正報告書 (Word)
- 書式8:緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書 (Word)
- 書式9:緊急の危険を回避するための治験実施計画書からの逸脱に関する通知書 (Word)
- 書式10:治験に関する変更申請書 (Word)
- 書式11:治験実施状況報告書 (Word)
- 書式12:重篤な有害事象に関する報告書(医薬品治験) (Word)
- 書式13:重篤な有害事象に関する報告書(医薬品製造販売後臨床試験) (Word)
- 書式14:重篤な有害事象及び不具合に関する報告書(医療機器治験) (Word)
- 書式15:重篤な有害事象及び不具合に関する報告書(医療機器製造販売後臨床試験) (Word)
- 書式16:安全性情報等に関する報告書 (Word)
- 書式17:治験終了(中止・中断)報告書 (Word)
- 書式18:開発の中止等に関する報告書 (Word)
- 書式19:重篤な有害事象及び不具合に関する報告書(再生医療等製品治験) (Word)
- 参考書式1:治験に関する指示・決定通知書(Word)
様式等
治験と治験薬の概要(Word)










